Enzymer får næsten alle biokemiske processer til at forløbe i cellerne – uden dem vil de fleste kemiske reaktioner slet ikke forløbe, eller det vil ske så langsomt at organismen ikke ville kunne leve.
Enzymer findes naturligt i alle levende organismer, men vi finder det også i fx vaskepulver.
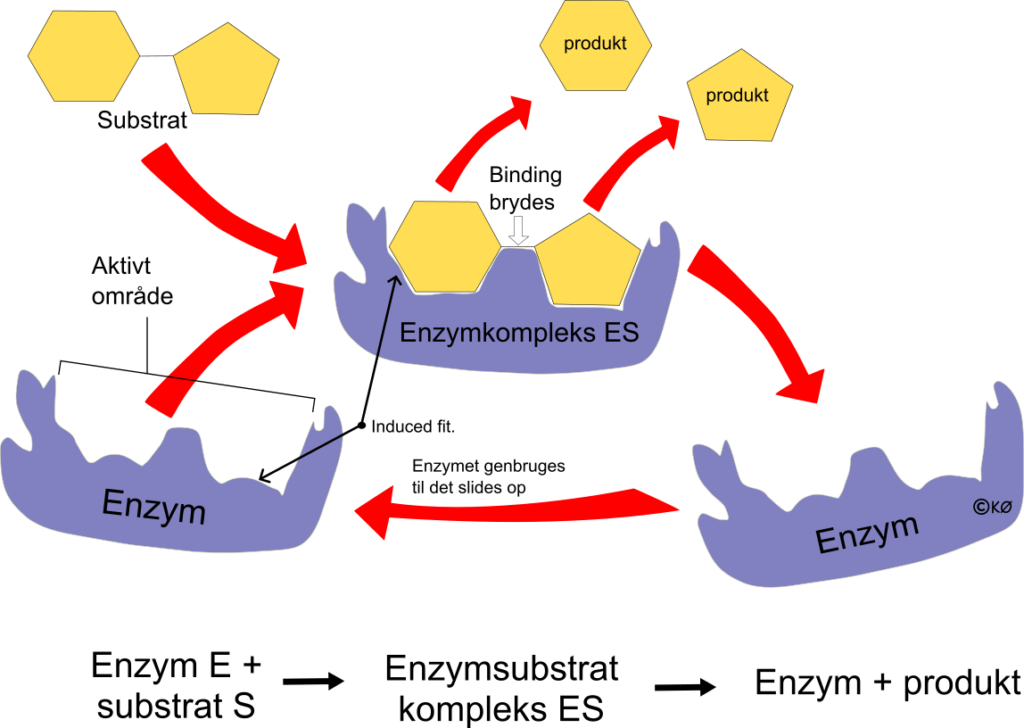
Substrat og enzym bindes sammen
Fakta om enzymer
Katalysator – de igangsætter en reaktion, men deltager ikke selv i den.
Genbruges – De kan bruges igen og igen indtil de bliver slidt op
Specifikke – Enzymer er designet til at nedbryde, opbygge eller ændre et præcist substrat.
Nedsætter aktiveringsenergien – Enzymer binder sig til substratet og nedsætter den aktiveringsenergi der skal til for at reaktionen finder sted.
Proteiner – Enzymer består af aminosyrer, og kan denaturere (ødelægges) ved høj varme.
Aktive områder – Er områder på enzymet hvor substratet binder sig.
Enzymer kan både nedbryde, opbygge eller omdanne substrat
CO-enzymer. Nogle enzymer skal aktiveres af CO-enzymer eller metalioner for at virke.
Når enzymet (E) binder sig til substratet (S), fastholdes det ved forskellige kemiske bindinger, og danner et enzymsubstrat kompleks (ES). Enzymet bryder bindingen i substratet og frigivet produktet (P) og enzymet (E), som genbruges til det bliver slidt op. Når substratet bliver bundet i enzym-substrat komplekset, så skifter enzymet form for at lette processen, og den ændring kaldes – induced fit. Efter produktet frigives, så indtager enzymet sin oprindelige form.
Kemiske binder mellem substrat og enzym
Lad os se nærmere på de kemiske bindinger, som fastholder substratet til enzymet. Der er 5 forskellige typer, som sikrer at enzym og substrat fastholdes, men også at enzymet er specifikt, så det ikke er det forkerte substrat som nedbrydes.
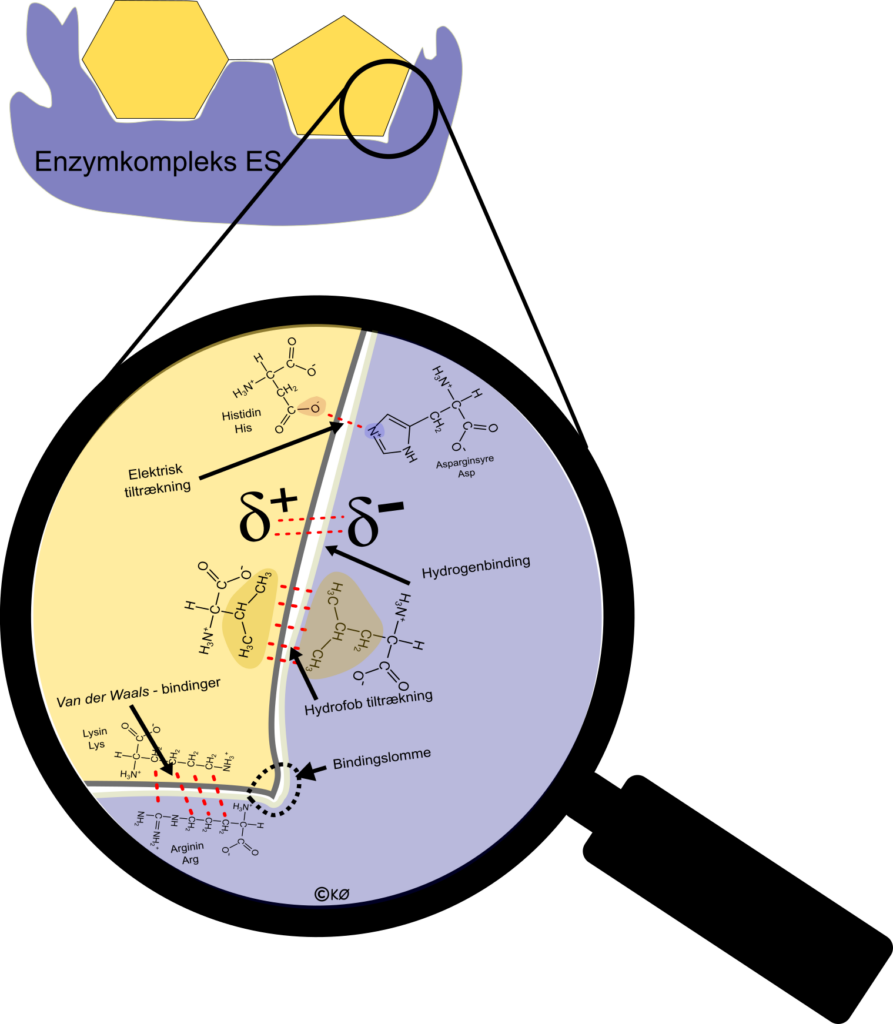
Elektrisk tiltrækning. Flere aminosyrer i substrat og enzym er elektrisk ladet. I figuren ses den negative histidin og den positive asparginsyre danne en tiltrækning. Den tiltrækning er relativ høj
Hydrogenbindinger opstår mellem polære molekyler. Det er de bindinger som får vand til at hænge så godt sammen at det skal varmes op til 100 grader før de giver slip på hinanden. Vi finder også hydrogenbindinger i midten af DNA. Hydrogenbindinger er de kraftigste bindinger, men ikke så kraftige som diatomare (kovalente) bindinger!
Hydrofob tiltrækning sker mellem to upolære molekyler – her to aminosyrer .
Bindingslomme. Enzymer er 3D molekyler, for for at substrat og enzym kan bindes tæt, så skal de passe sammen i opbygning. Man kan sammenligne det med en lås og en nøgle som skal passe sammen.
Van der Waals bindinger sker mellem uladede molekyler. Tiltrækningen sker, når molekyler meget kortvarigt har en ladning pga. bevægelsen af elektroner. Denne binding er svagere end hydrogenbindinger.
Enzymer kan sætte "umulige" reaktioner i gang
En sukkerknald kan brænde, men den selvantænder ikke, for der er ikke nok energi ved stuetemperatur til at starte en forbrænding. Selv hvis vi sætter en tændstik til sukkeret, vil det ikke brænde. Det virker ikke logisk, fordi sukker jo indeholder meget brændbart energi (17 KJ/g). Du skal op på en endnu højere temperatur inden sukker antænder og forbrænder.
Men din krop kan forbrænde sukker. Og det er ved sølle 37 grader! Hemmeligheden er enzymerne, som nedsætter den temperatur der skal til for at sætte reaktionen i gang.

Uanset om der sættes ilt til sukkeret eller det forbrændes i kroppen er det nogenlunde denne proces som finder sted. C6H12O6 + 6 O2 -> 6 CO2 + 6 H2O + Energi
Den store forskel er enzymer og temperatur.
Reaktionen skal bruge energi for at blive sparket i gang – aktiveringsenergi
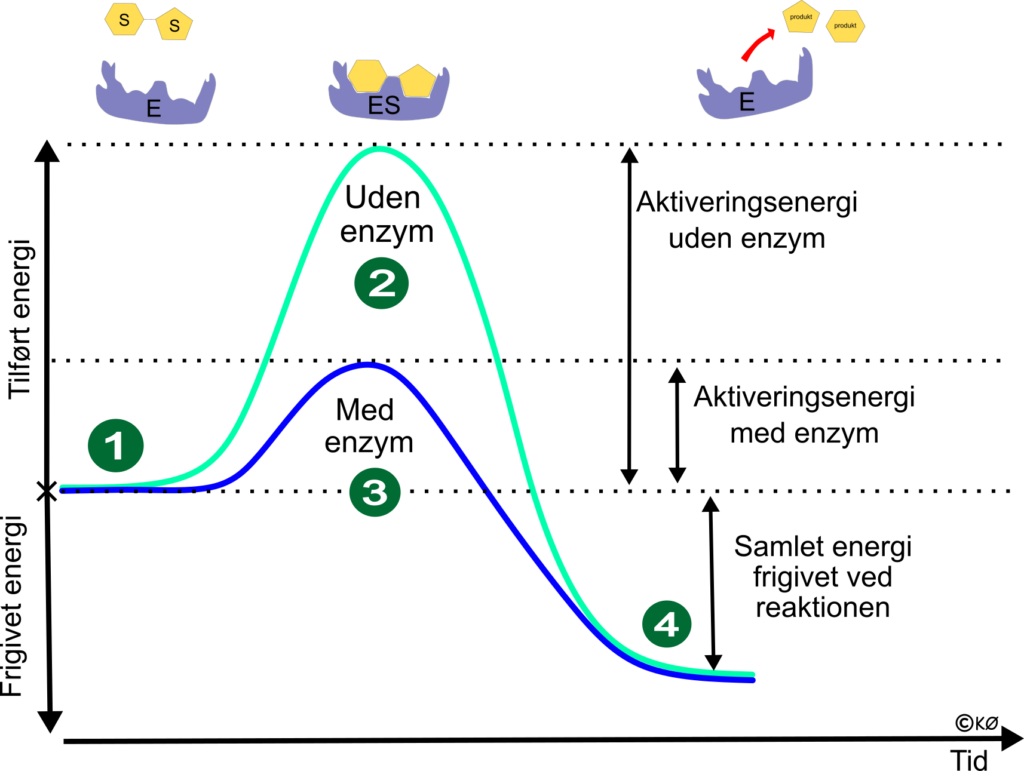
Sukker selvantænder ikke når det står på bordet, for der skal meget energi til at starte forbrændingen. Den energi – aktiveringsenergien kan enzymer nedsætte.
- Substratet indeholder kemisk bundet energi – fx glukose på 17 kj/g.
- Hvis sukkeret skal forbrænde uden enzym, skal der tilføres ekstra aktiveringsenergi, så vi når op på højeste energiniveau. Men når ikke op på den energitilførsel, vil reaktionen ikke finde sted.
- Her er der tilsat et enzym, som katalyserer reaktionen. Der dannes et enzymkompleks (ES) og nu skal der ikke tilføres så meget energi før reaktionen finder sted. Har vi nok energi i omgivelserne – fx en kropstemperatur på 37 ͦ C, vil reaktionen finde sted.
- Energiniveauet falder nu, fordi den kemiske bindingsenergi i sukkeret er omdannet til energi (ATP i mennesket, eller varme og lys i et bål). Ud over energi, står vi tilbage med produktet af reaktionen samt enzymerne, som kan genbruges.
Endoterm og exoterm
Exoterm reaktion: En forbrænding af glukose afgiver energi. Exoterme reaktioner kendes på at de bliver varme eller lyser.
Endoterm: En reaktion modtager energi for at kunne forløbe. Fx modtager fotosyntesen energi fra lyset for at reaktionen kan finde sted. Gendannelse af ATP ud fra ADP og Pi er også endoterm, mens den modsatte reaktion er exoterm.
Reaktioner kan løbe begge veje
Reaktionspilen ¦ viser hvilken vej reaktionen forløbet. Men reaktionen vil altid løbe i den retning hvor produkterne indeholder mindst bunden energi. Fx vil det energirige glukose omdannes til CO2 og H2O som ikke indeholder bunden energi. Der er reaktioner som indstiller en ligevægt – dvs. de kan løbe begge veje. Om reaktionen er forskudt til højre eller venstre afhænger af temperatur, tryk, volumen og tryk. Det lærer du mere om i kemiB.
Enzymer ender ofte på -ase
De du kan genkende et enzym på navnet, for slutter det på -ase er det ofte et enzym. Fx amylase, peptidase, peroxidase, lipase og maltase.
CO-enzymer
Det overfører stoffer stoffer til substratet. Mest kendt er P som overføres til ADP for at danne ATP. I nedbrydning af glukose i cellen møder vi også NADH og NADPH, som kan overføre H – de er også er energirige molekyler ligesom ATP. Ikke alle CO-enzymer kan dannes af kroppen, så dem skal vi have tilført med kosten som vitaminer. B3-vitamin omdannes fx til NADH og NADPH.
Reaktionstyper
Brydes en peptidbinding (se skema) i et protein spaltes der vand og -OH og H sætter sig på aminosyreenderne. Processen kaldes hydrolyse, fordi vand spaltes. Det samme sker i spaltningen af kulhydrat, lipid. Enzymerne som katalyserer processen, proteaser, amylaser og lipaser, kaldes derfor hydrolaser. Se skemaet over de forskellige reaktionstyper (især vigtigt på bioA).
Reaktionshastigheder
Enzymernes hastighed afhænger af:
- Enzymkoncentration
- Substratkoncentration
- Temperatur
- pH
- Hæmmende stoffer og miljøfremmede stoffer.
Temperatur
Reaktionshastigheden øges ved øget temperatur. En hugorm er vekselvarm og meget sløv i det kølige forår. Derfor ligger den i solen for at blive varmet op, så enzymerne virker hurtigere og den kan blive mere aktiv og fange sit bytte. Enzymerne virker hurtigere, fordi molekylerne (både enzymer og substrat) bevæger sig hurtigere, og jo flere sammenstød, jo mere substrat bliver omdannet. I starten er udviklingen eksponentiel.
Når vi sætter maden i køleskabet, er det for at nedsætte enzymernes hastighed i bakterier og svampe i maden, så de ikke formerer sig for hurtigt og fordærver maden.
Ved ølbrygning udmæsker vi malten i processen ved at hæve temperaturen til 78 ͦ C. Det gør vi for at ødelægge enzymerne i bakterierne, så de ikke ødelægger øllet. Ved høj temperatur denaturerer enzymerne og
mister den 3D struktur som gør at de kan katalysere substrat. Processen er irreversibel, dvs. enzymerne kommer aldrig til at virke igen, heller ikke hvis vi sænker temperaturen igen. Denaturering af protein ser vi også, når vi slår et æg ud på en varm pande – proteinerne denaturerer og bliver hvide. Husk at enzymer er proteiner.
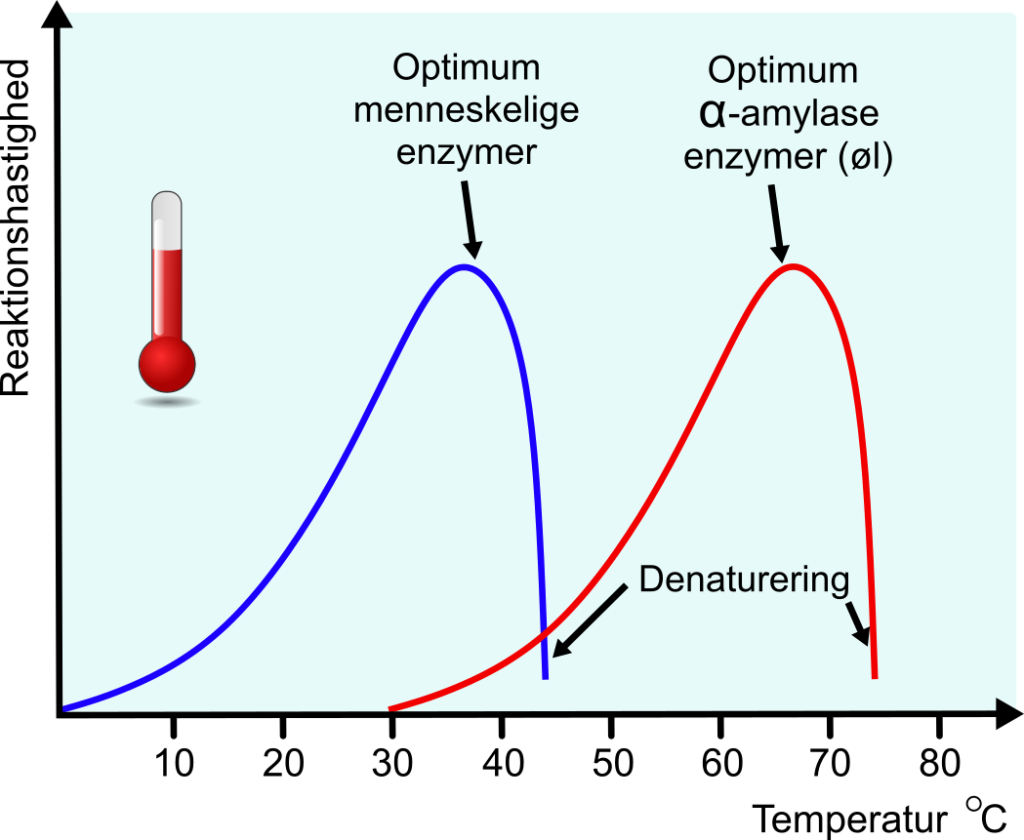

Det er ikke alle enzymer som denaturerer ved temperaturer over kropstemperaturer. Vi har fundet bakterier i varme kilder, som har ekstreme enzymer, som kan fungere ved høje temperaturer. Vi kalder dem termofile.
Figuren ovenfor viser temperaturkurven for enzymer hos mennesket og mange andre dyr og den optimale temperatur er 37 ͦ C. Ved ølbrygning er der mange enzymer i funktion, men de har optimum ved flere forskellige temperaturer. Med mæskningen udsættes det valsede korn for forskellige temperaturer, så vi rammer optimum for flere forskellige enzymer. Enzymer som virker ved høje temperaturer kaldes termofile.
pH
Hvis pH ændres, vil reaktionshastigheden ændres, og ligesom ved temperatur findes der også et optimum for pH. Pepsin som er aktivt i maven, det har et optimum på pH 1,5-2. Amylase derimod virker ved neutral pH i munden og i 12-fingertarmen. Ændres pH væsentligt for et enzym vil det denaturere og ikke længere fungere, men det er reversibelt og kan fungere igen, når pH nærmer sig optimum. De fleste enzymer har optimum tæt på neutral.
Årsagen til pH ændrer reaktionshastigheden, er fordi ladningerne ændres på substratet og det aktive område på enzymet, og det ændrer bindingen mellem de to og dermed reaktionshastigheden.

Enzymkoncentration
Jo flere enzymer, jo flere er der til at lave arbejdet. Derfor vil reaktionshastigheden stige lineært når koncentrationen af enzymer øges. To enzymer omsætter dobbelt så meget substrat som et.
Det forudsætter selvfølgelig at der er nok substrat og at andre parametre som pH og temperatur holdes konstant. Hastigheden regnes som enheder pr. mL opløsning.

Substratkoncentration
Øger vi koncentrationen af substrat øges reaktionshastigheden naturligvis også, men den er kun lineær i starten og så aftager stigningen i reaktionshastigheden. Forestil dig enzym og substratmolekyler i blandingen i begyndelsen – der er ledige enzymer og hvis der tilsættes dobbelt så meget substrat, så fordobles hastigheden – dvs. proportionalt. Men på et tidspunkt er alle enzymer optaget, og når vi øger koncentrationen af substrat, så er der substratmolekyler som ”venter” på et ledigt enzym, og så aftager hastigheden. Vi nærmer os en stiplet linje som er enzymets maksimale reaktionshastighed.

Hæmning af enzymer
Et stof som binder sig til enzymet og hæmmer det kaldes en inhibitor. De kan både bindes reversibelt, dvs. de kan ”slippe igen”, men irreversible inhibitorer som fx tungmetaller binder sig så kraftigt, at enzymet mister sin funktion eller antibiotikummet penicillin, som dræber bakterier ved at hæmme enzymerne som skal danne cellevæggen.
En inhibitor, som ligner substratet meget, kan også binde sig til det samme aktive sted på enzymet og på den måde hindre substratet i at binde sig og omdannes. Det er en Kompetitiv inhibitor som konkurrerer om pladsen på det aktive sted. Det udnyttes i det smertestillende acetylsalicylsyre.
Ikke alle inhibitorer binder sig til det aktive område.

